第一期:从脂质组学兴起到串联质谱深度解析策略|AC综述特刊

近日,清华大学化学系瑕瑜教授、精密仪器系张文鹏副教授及同系博士后刘易昆(现清谱科技创新设计中心脂质组学科学家),于分析化学领域国际权威期刊Analytical Chemistry发表了题为“Structural Lipidomics Enabled by Isomer-Resolved Tandem Mass Spectrometry”的综述文章,系统阐述了结构脂质组学这一前沿交叉领域的发展与趋势。
该文系统梳理了串联质谱(MS/MS)技术用于脂质精细结构表征的原理与方法学进展,阐述了脂质结构解析技术与多元分析平台相集成的工作流程,回顾了近年来该方向在基础代谢研究与生物医学应用中的关键成果,并对当前面临的方法学挑战与未来发展趋势进行了展望。
为深入探究这一新兴领域,我们将分三期对该综述的核心内容进行系统性解读。本期首先围绕结构脂质组学的学科背景与发展脉络,系统阐述基于串联质谱的脂质精细结构解析策略,内容涵盖C=C位置、sn-位置、脂酰链修饰鉴定及异构体定量分析等关键技术模块,以期为相关研究提供清晰、完整的技术框架参考。
脂质组学的兴起
脂质是细胞区室化、能量储存和信号传导所必需的多功能生物分子,在生命活动中发挥着不可或缺的作用。自2003年脂质组学概念被提出以来,其在人类健康和疾病相关的基础研究与转化研究中的重要性日益凸显。与蛋白质组不同,脂质组可作为生物系统代谢状态的动态指标。因此,研究机体状态变化后脂质组的改变,为揭示脂质功能及其与其他分子的相互作用、识别新药物靶点以及开发创新的诊断或治疗程序提供了新的机遇。
见微知著:脂质精细结构解析的意义
脂质组学分析的核心目标之一是对脂质组中脂质分子实现全面的鉴定与定量。然而,脂质鉴定远比基因测序或蛋白质表征更为复杂。为准确鉴定某一脂质分子,必须获取涵盖多个结构层次的信息,包括:1)头基类型;2)酰基链组成;3)C=C位置;4)sn-位置;5)链修饰基团种类及位置;6)C=C的立体异构和手性中心。脂质共分为八类:脂肪酸类、甘油脂类、甘油磷脂类、鞘脂类、固醇脂类、孕烯醇酮脂类、糖脂类和多聚乙烯类,不同类别脂质多结构层次各自的化学多样性相互组合,可形成数量庞大的潜在脂质结构。截至2025年12月,LIPID MAPS结构数据库收录的脂质结构数量已经超过5万种,并且近年来仍在持续增长。
道阻且长:传统脂质分析技术的成就与边界
高效分离技术、高分辨质谱仪及先进串联质谱方法的发展,使得在脂质亚类层面和链组成水平上,对数百种脂质进行跨3–5个数量级动态范围的常规分析成为可能。然而,这些方法大多无法区分仅在精细结构层次上存在差异的脂质异构体,例如C=C位置、顺/反构型、sn-位置以及链修饰类型等。由于脂质异构体的标准品较为缺乏,传统质谱方法在脂质注释中常面临鉴定模糊的问题,且不规范的数据报告可能进一步导致结果混淆。为此,国际脂质组学学会提出了“脂质组学最低报告清单”,旨在规范该领域数据的生成、报告与发表。
新程肇启:结构脂质组学的兴起之路
过去二十年间,多种新型串联质谱技术不断发展,实现在精细结构水平上对脂质异构体的鉴定与区分。这些进展共同为脂质组学中一个新兴方向——“结构脂质组学”奠定了基础。借助这些新方法,研究人员开始系统绘制曾被视作“难以解析”或“尚未明确”的脂质组结构图谱,揭示脂质异构体特有的代谢路径,并挖掘与疾病诊断相关的潜在脂质标志物。
基于串联质谱对脂质进行全面结构表征
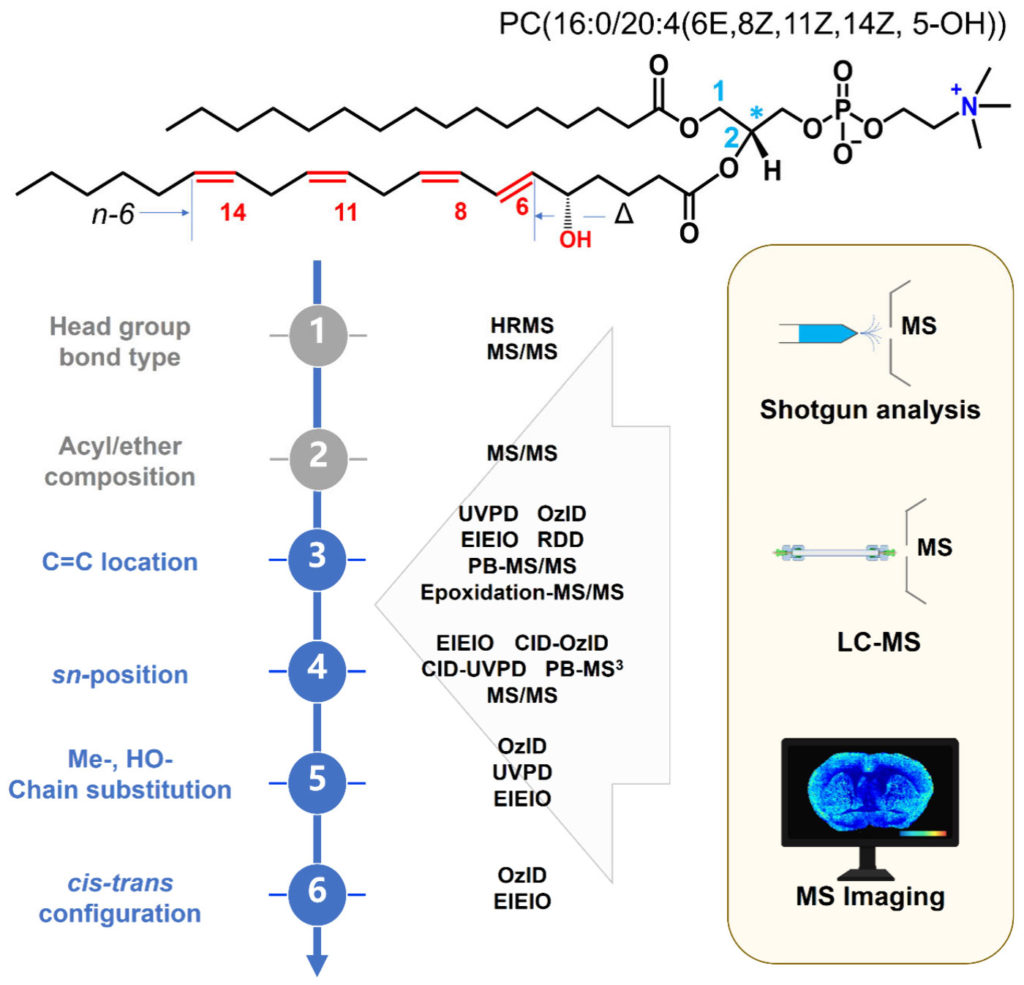
图 1. 磷脂酰胆碱分子(PC 16:0/20:4(6E,8Z,11Z,14Z,5-OH))的结构层次与不同结构水平脂质的质谱表征方法
C=C位置鉴定
常规的碰撞诱导解离(CID)难以直接断裂脂质中的C=C双键,导致传统的脂质组学工作流程通常无法获取其位置信息。为突破这一瓶颈,目前主要发展出两大类核心策略:气相离子活化与化学衍生化。
1. 气相离子活化技术
臭氧诱导解离(OzID):该技术是一种在质谱仪中发生的气相臭氧解离反应。其原理是C=C双键与臭氧发生离子-分子反应,生成初级臭氧化物,该中间体继而解离产生一个醛离子和一个Criegee离子,从而可判断C=C双键在原分子中的具体位置。
紫外光解离(UVPD):该技术基于C=C双键对193 nm与213 nm波长的紫外光具有特异性弱吸收的性质,可在紫外光辐照条件下引发电子激发。这导致脂质离子中与C=C相邻的C−C键断裂,生成一对质量差为24 Da的C=C位置诊断离子。
其他活化方法:包括有机物离子的电子冲击激发(EIEIO)、自由基定向解离(RDD)、远电荷碎裂(CRF)、氧附着解离(OAD)、亚稳态原子激发解离(MAD)以及共价加合物化学电离(CACI)等。其中,EIEIO通过使带正电荷的脂质离子与动能约为10 eV的电子束相互作用,引发母离子的电子激发,从而触发广泛的高能量裂解与自由基导向的裂解途径,可用于推断C=C位置并区分其顺/反构型及sn-位置。
2. 化学衍生化技术
Paternò–Büchi(PB)反应:PB反应是指电子激发后的酮或醛与C=C之间的[2+2]环加成反应,其对C=C具有高度特异性。例如,以丙酮为试剂时,反应产物经CID裂解可产生一对质量差26 Da的诊断离子,用于确定C=C位置。目前已开发出多种改进型PB试剂(如三氟苯乙酮、乙酰吡啶、苯甲酰甲酸甲酯等)以及可见光催化策略,旨在提高反应效率、特异性,并增强对非极性脂质的检测灵敏度。自2014年瑕瑜课题组首次将PB反应用于不饱和脂质结构分析(相关论文发表于Angew Chem Int Ed Engl. 2014;53(10):2592-2596)以来,基于该反应的脂质分析方法学已得到迅速发展,相关文献累计超过100篇。
环氧化:脂质中的C=C双键可通过环氧化反应转化为极性且高度不稳定的三元环。通过对脂质环氧化物进行CID,三元环碎裂形成一对相差16 Da的碎片离子,可实现C=C位置的鉴定。
氮丙啶化:该方法通过对C=C双键进行氮丙啶化反应,在脂质分子中引入三元环胺官能团(氮丙啶)。在碰撞诱导解离过程中,氮丙啶环发生断裂,从而在不同类型的脂质中产生用于确定C=C双键位置的诊断离子。
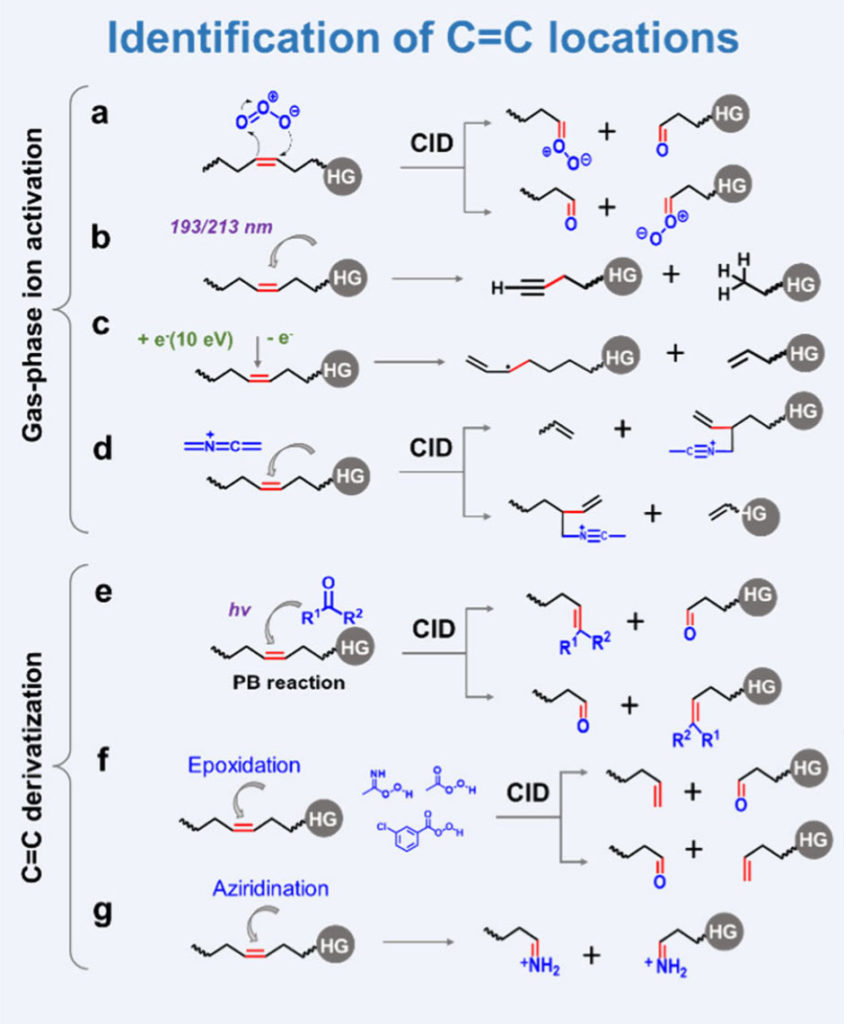
图 2. 鉴定脂质C=C位置的质谱方法:(a)OzID,(b)UVPD,(c)EIEIO,(d)CACI,(e)PB反应,(f)环氧化,(g)氮丙啶化
sn-位置鉴定
sn-位置是指脂肪酰基与甘油骨架特定碳原子之间的连接位置。
传统上,甘油磷脂中脂肪酰基sn-位置的鉴定,主要基于其负离子经二级质谱碰撞诱导解离所产生的两个脂肪酰基碎片离子的相对丰度比较。经验表明,sn-2位脂肪酰基离子的相对丰度通常高于sn-1位,但例外情况并不少见。由于缺乏sn-位点特异性离子,该方法难以对混合物中低丰度的sn-位置异构体进行准确的鉴定与定量。
Hsu等人和Kirschbaum等人的研究表明,质子化或金属离子加合的甘油磷脂在CID过程中,会发生sn-2位Cα-H向磷酸头基的专一性转移,随后磷酸头基的丢失会形成一个二氧戊环型碎片离子,其sn-2酰基链的前两个碳原子之间会形成一个新的双键。
基于这一独特结构,Pham 等人开发了一种用于鉴定 sn-位置异构体的 MS³ 方法,其步骤为:先对甘油磷脂的钠离子加合物进行 MS² CID,随后对产生的特征碎片进行OzID。类似的 MS³ CID-OzID 策略也被应用于定位甘油三酯中脂肪酰基的 sn-取代模式。Williams 等人则利用 MS³ CID-UVPD 来测定甘油磷脂的 sn-位置异构体。Cao 等人将 PB 衍生化反应与 MS³ CID 相结合,实现了对甘油磷脂的 C=C 位置及 sn-位置的鉴定。
另一类策略涉及对甘油磷脂分子与强结合阴离子或阳离子所形成的加合物进行MS²或MS³ CID。例如,Zhao等人发现,碳酸氢根阴离子能与磷脂酰胆碱的磷酸胆碱头基形成强非共价相互作用。此作用在CID过程中能促进C–N键发生均裂,产生自由基阴离子并触发自由基定向解离,从而形成一个sn-1位特异性碎片,使得能够高置信度地鉴定磷脂酰胆碱的sn-位置异构体。
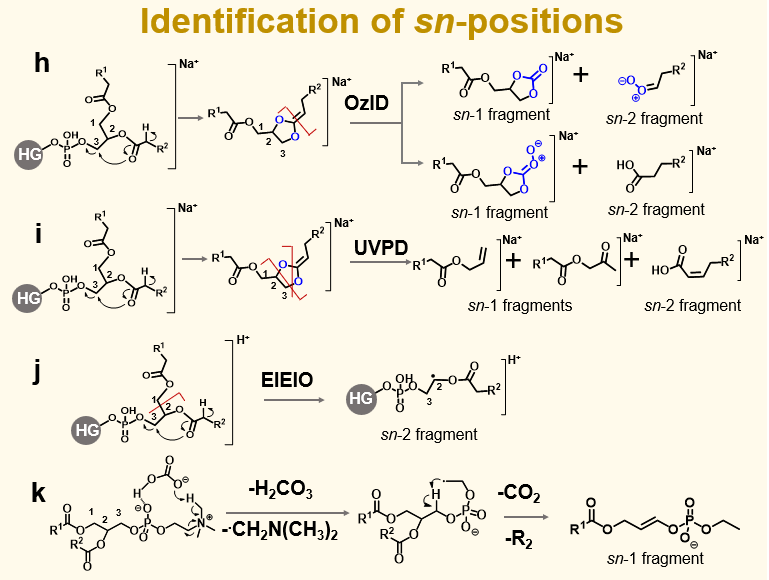
图 3. sn-位置鉴定方法:(h)MS³CID-OzID,(i)MS³CID-UVPD,(j)EIEIO,(k)PC或LPC([M+HCO₃]⁻)的MS²CID
链修饰分析
生物脂质组中还存在着脂肪酰基/烷基链上的其他修饰,如甲基分支、碳环结构、羟基化及硝化等。支链脂肪酸在其脂肪酰基链上可含有一个或多个甲基分支。氧化脂质则包含氢过氧化物、酮类和环氧化物等多种亚型。环丙烷脂质常见于细菌和植物脂质组中,其脂肪酰基链中的环丙烷环结构,使得该类脂质相较于典型不饱和脂肪酸具有更高的结构刚性和化学稳定性。Blevins等人利用193 nm紫外光解离技术,实现了对细菌样品甘油磷脂中环丙烷修饰的定位。
另一方面,基于自由基或电子的离子活化方法以及电荷远程碎裂技术,能够沿脂肪酰基链产生链内碎片,这些方法已被开发用于脂质链修饰的表征。例如,对经由电子轰击电离产生的饱和支链脂肪酸甲酯分子离子进行碰撞诱导解离,可根据产生的、对应于末端异丙基或甲基的产物离子,对支链结构进行可靠鉴定。
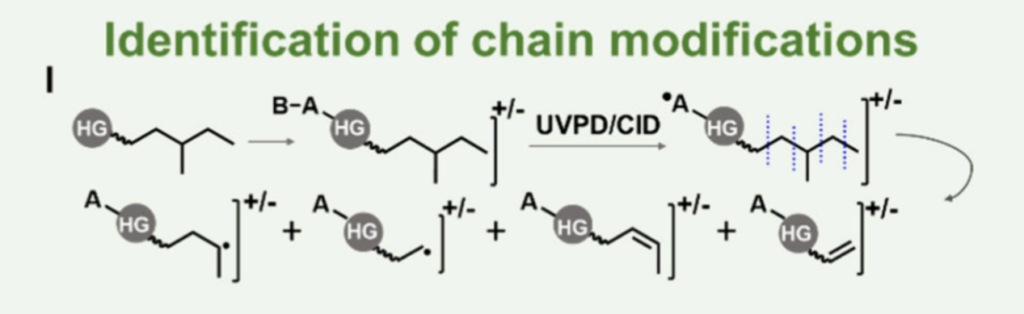
图 4. RDD用于鉴定链修饰
脂质异构体的定量分析
由于异构体分辨串联质谱能够区分混合物中的不同异构体,因此可实现脂质异构体的组成分析。对于无法通过色谱分离的脂质异构体,可利用异构体分辨串联质谱中产生的、各同分异构体特有的碎片离子(例如,C=C诊断离子或sn-位特异性碎片离子),对共存的异构体进行组成分析。当可获得异构体的标准品时,以诊断离子丰度比相对于异构体摩尔比作图,即可建立线性校准曲线,并据此计算异构体的摩尔分数。若无标准品,则可通过诊断离子的丰度比或占比,实现异构体组成的相对定量。该方法对于监测脂质代谢紊乱及筛选差异脂质极具价值。
同重标记技术已被整合到异构体分辨串联质谱中,用于在C=C双键位置水平上对脂质异构体进行并行定量。例如,Feng等人开发了一种利用同重多重标记策略进行脂肪酸定量分析的方法。为对C=C双键进行衍生化,在含羰基化合物(SUGAR)标记前需使用间氯过氧苯甲酸(m-CPBA)进行环氧化反应。具体流程为:将等量样品水解获得的脂肪酸经m-CPBA环氧化后,再用4重SUGAR标签进行标记。对由此得到的双重衍生化C=C位置异构体进行反相液相色谱(RPLC)-串联质谱分析,不仅能产生用于定位C=C的诊断离子,还能得到用于脂肪酸四通道定量分析的报告离子。Armbruster等人则采用6重同重季铵盐标签,通过氯胺-T对脂肪酸的C=C双键进行甲苯磺酰化衍生化。该方法能对未经色谱分离的C=C位置异构体进行并行定量分析。在串联质谱过程中,带电荷的质量报告离子被释放,从而便于在脂质亚类及C=C位置水平进行相对定量。类似地,Feng等人还开发了一种基于N-甲基氮杂环丙烷化的稳定同位素标记策略,可实现不饱和脂质C=C双键位置异构体的同步定性与定量分析。
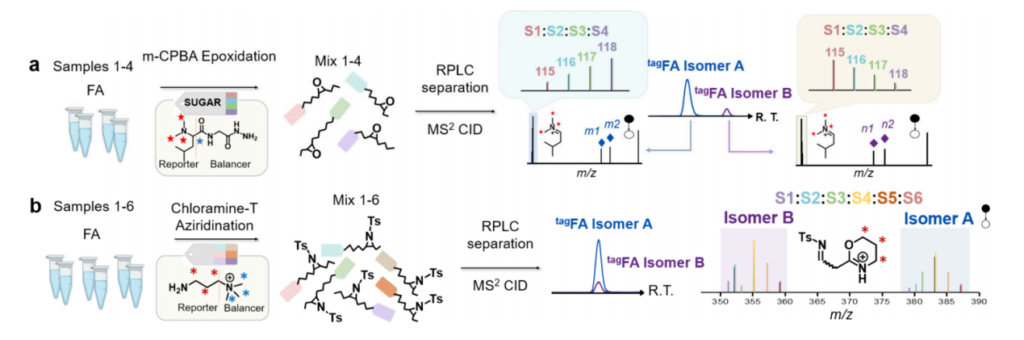
图 5. (a)采用SUGAR标签与m-CPBA环氧化反应对脂肪酸C=C位置异构体A与B(C=C键分别位于Δm和Δn位)进行定量分析与结构解析;(b)通过氯胺-T与甲苯磺酰基双重标记对脂肪酸C=C位置异构体A与B进行定量分析与结构解析的流程示意图
本期总结
本期重点解读了基于串联质谱的脂质精细结构解析策略。从C=C位置、sn-位置到酰基链修饰的鉴定,再到异构体的定量分析,一系列创新技术如同为脂质组学研究配上了“视力矫正眼镜”,使我们得以清晰辨识曾经模糊的脂质异构体世界,为从分子层面理解生命过程与疾病机制提供了强大工具。
然而,将这些解析技术高效地应用于真实生物样本,还需要与不同的分析平台深度整合。在第二期内容中,我们将介绍结构脂质组学的分析工作流程,敬请期待~
原文链接:
